Kapitola 10. Pevné látky a kapaliny
- popište, co se stane během změny fáze.
- Vypočítejte změnu energie potřebnou pro změnu fáze.
látky mohou měnit fázi-často kvůli změně teploty. Při nízkých teplotách je většina látek pevná; jak se teplota zvyšuje, stávají se tekutými; při vyšších teplotách se stávají plynnými.
proces přeměny pevné látky na kapalinu se nazývá tavení (starší termín, který můžete někdy vidět, je fúze). Opačný proces, kapalina se stává pevnou látkou, se nazývá tuhnutí. Pro každou čistou látku je pro tuto látku charakteristická teplota, při které dochází k tání — známá jako teplota tání. Vyžaduje energii, aby se pevná látka roztavila na kapalinu. Každá čistá látka má určité množství energie, které potřebuje ke změně z pevné látky na kapalinu. Toto množství se nazývá entalpie fúze (nebo teplo fúze) látky, reprezentované jako ΔHfus. Některé hodnoty ΔHfus jsou uvedeny v tabulce 10.2 „entalpie fúze pro různé látky“; předpokládá se, že tyto hodnoty jsou pro teplotu tání látky. Všimněte si, že jednotka ΔHfus je kilojoules na mol, takže potřebujeme znát množství materiálu, abychom věděli, kolik energie je zapojeno. ΔHfus je vždy tabulkován jako kladné číslo. Může se však použít jak pro tavení, tak pro procesy tuhnutí, pokud budete mít na paměti, že tavení je vždy endotermické (takže ΔH bude pozitivní), zatímco tuhnutí je vždy exotermické (takže ΔH bude negativní).
| látka (teplota tání) | ΔHfus (kJ / mol) |
|---|---|
| voda (0°C) | 6.01 |
| hliník (660°C) | 10.7 |
| benzen (5,5°C) | 9.95 |
| Ethanol (-114,3°C) | 5.02 |
| rtuť (-38,8°C) | 2.29 |
jaká je změna energie, když se 45,7 g H2O roztaví při 0°C?
roztok
ΔHfus H2O je 6,01 kJ / mol. Naše množství je však uvedeno v jednotkách gramů, nikoli mol, takže prvním krokem je převést gramy na mol pomocí molární hmotnosti H2O, což je 18,0 g / mol. Pak můžeme použít ΔHfus jako konverzní faktor. Protože se látka taví, proces je endotermický, takže změna energie bude mít pozitivní znamení.
![]()
bez znamení se předpokládá, že číslo je kladné.
Otestujte se
jaká je změna energie, když 108 g C6H6 zamrzne při 5,5°C?
odpověď
-13.8 kJ
během tavení jde energie výhradně ke změně fáze látky, nejde o změnu teploty látky. Tání je tedy izotermický proces, protože látka zůstává na stejné teplotě. Teprve když se roztaví veškerá látka, dojde ke změně její teploty.
co se stane, když se pevná látka stane kapalinou? V pevné látce jsou jednotlivé částice uvízlé na místě, protože intermolekulární síly nemohou být překonány energií částic. Pokud je dodáno více energie (např., zvýšením teploty), přichází bod, ve kterém mají částice dostatek energie k pohybu, ale ne dostatek energie k oddělení. Toto je kapalná fáze: částice jsou stále v kontaktu, ale jsou schopny se pohybovat kolem sebe. To vysvětluje, proč kapaliny mohou mít tvar svých nádob: částice se pohybují kolem a pod vlivem gravitace plní nejnižší možný objem (pokud není kapalina v prostředí s nulovou gravitací-viz obrázek 10.16 „kapaliny a gravitace“).

změna fáze mezi kapalinou a plynem má určité podobnosti se změnou fáze mezi pevnou látkou a kapalinou. Při určité teplotě mají částice v kapalině dostatek energie, aby se staly plynem. Proces, kdy se kapalina stává plynem, se nazývá varu (nebo odpařování), zatímco proces, kdy se plyn stává kapalinou, se nazývá kondenzace. Na rozdíl od procesu přeměny pevná látka / kapalina je však proces přeměny kapalina / plyn znatelně ovlivněn okolním tlakem na kapalinu, protože plyny jsou silně ovlivněny tlakem. To znamená, že teplota, při které se kapalina stává plynem, bod varu, se může měnit s okolním tlakem. Proto definujeme normální bod varu jako teplotu, při které se kapalina mění na plyn, když okolní tlak je přesně 1 atm nebo 760 torr. Pokud není uvedeno jinak, předpokládá se, že bod varu je pro 1 atm tlaku.
stejně jako změna pevné / kapalné fáze zahrnuje změna fáze kapalina / plyn energii. Množství energie potřebné k přeměně kapaliny na plyn se nazývá entalpie odpařování (nebo teplo odpařování), reprezentované jako ΔHvap. Některé hodnoty ΔHvap jsou uvedeny v tabulce 10.3 „entalpie odpařování pro různé látky“; předpokládá se, že tyto hodnoty jsou pro normální teplotu bodu varu látky, která je také uvedena v tabulce. Jednotka pro ΔHvap je také kilojoules na mol, takže potřebujeme znát množství materiálu, abychom věděli, kolik energie je zapojeno. ΔHvap je také vždy uveden v tabulce jako kladné číslo. Může být použit jak pro varné, tak pro kondenzační procesy, pokud budete mít na paměti, že vaření je vždy endotermické (takže ΔH bude pozitivní), zatímco kondenzace je vždy exotermická (takže ΔH bude negativní).
| látka (normální teplota varu) | ΔHvap (kJ / mol) |
|---|---|
| voda (100°C) | 40.68 |
| brom (59,5°C) | 15.4 |
| benzen (80,1°C) | 30.8 |
| Ethanol (78,3°C) | 38.6 |
| rtuť (357°C) | 59.23 |
jaká je změna energie, když 66,7 g Br2 (g) kondenzuje na kapalinu při 59,5°c?
roztok
ΔHvap Br2 je 15,4 kJ / mol. I když se jedná o kondenzační proces, stále můžeme použít číselnou hodnotu ΔHvap, pokud si uvědomíme, že musíme odebírat energii, takže hodnota ΔH bude záporná. Abychom zjistili velikost změny energie, musíme nejprve převést množství Br2 na krtky. Pak můžeme použít ΔHvap jako konverzní faktor.
![]()
protože proces je exotermní, skutečná hodnota bude záporná: ΔH = -6,43 kJ.
Otestujte se
jaká je změna energie, když se 822 g C2H5OH(ℓ) vaří při normální teplotě varu 78,3°c?
odpověď
689 kJ
stejně jako při tavení jde energie ve varu výhradně ke změně fáze látky, nejde o změnu teploty látky. Takže vaření je také izotermický proces. Pouze tehdy, když se veškerá látka vaří, dojde ke změně její teploty.
co se stane, když se kapalina stane plynem? Již jsme zjistili, že kapalina je složena z částic, které jsou ve vzájemném kontaktu. Když se kapalina stane plynem, částice se od sebe oddělí, přičemž každá částice jde svou vlastní cestou ve vesmíru. Takto mají plyny tendenci plnit své nádoby. Ve skutečnosti je v plynné fázi většina objemu prázdným prostorem; pouze asi jedna tisícina objemu je skutečně zachycena hmotou (viz obrázek 10.17 „kapaliny a plyny“). Právě tato vlastnost plynů vysvětluje, proč mohou být stlačeny, což je uvedeno v kapitole 6 „plyny“.
za určitých okolností může pevná fáze přejít přímo do plynné fáze, aniž by prošla kapalnou fází, a plyn se může přímo stát pevnou látkou. Změna pevné látky na plyn se nazývá sublimace, zatímco reverzní proces se nazývá depozice. Sublimace je izotermická, stejně jako ostatní fázové změny. Během sublimace dochází k měřitelné změně energie; tato změna energie se nazývá entalpie sublimace, reprezentovaná jako ΔHsub. Vztah mezi ΔHsub a dalšími změnami entalpie je následující:
ΔHsub = ΔHfus + ΔHvap
jako takový není ΔHsub vždy tabulkový, protože jej lze jednoduše vypočítat z ΔHfus a ΔHvap.
existuje několik běžných příkladů sublimace. Známý produkt-suchý led – je ve skutečnosti pevný CO2. Suchý led je suchý, protože sublimuje, přičemž pevná látka obchází kapalnou fázi a jde přímo do plynné fáze. Sublimace nastává při teplotě -77°C, proto je třeba s ní zacházet opatrně. Pokud jste si někdy všimli, že kostky ledu v mrazáku mají tendenci se časem zmenšovat, je to proto, že pevná voda velmi pomalu sublimuje. „Mrazák burn“ není ve skutečnosti hořet; to nastane, když některé potraviny, jako je maso, pomalu ztrácí obsah pevné vody kvůli sublimaci. Jídlo je stále dobré, ale vypadá nechutně. Snížení teploty mrazničky zpomalí sublimaci pevné vody.
chemické rovnice lze použít k reprezentaci fázové změny. V takových případech je zásadní používat na látkách fázové štítky. Například chemická rovnice pro tání ledu za vzniku kapalné vody je následující:
H2O (s) → H2O (ℓ)
nedochází k žádné chemické změně; dochází však k fyzické změně.
topné křivky
graf teploty versus množství přidaného tepla je známý jako topná křivka (viz obrázek 10.18). Ty se běžně používají k vizuálnímu zobrazení vztahu mezi fázovými změnami a entalpií pro danou látku.
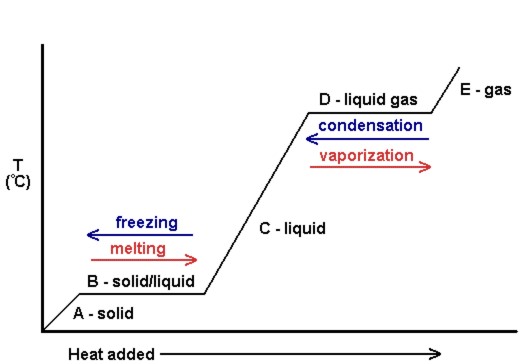
na obrázku 10.18 pevná látka získává kinetickou energii a následně se zvyšuje teplota při přidávání tepla. V bodě tání se přidané teplo používá k rozbití atraktivních mezimolekulárních sil pevné látky místo zvýšení kinetické energie, a proto teplota zůstává konstantní. Poté, co se veškerá pevná látka roztaví, přidané teplo opět zvyšuje kinetickou energii (a teplotu) molekul kapaliny až do bodu varu. V bodě varu se opět přidané teplo používá k rozbití atraktivních mezimolekulárních sil namísto dodávání kinetické energie a teplota zůstává konstantní, dokud se veškerá kapalina nezmění na plyn.
- fázové změny mohou nastat mezi dvěma fázemi hmoty.
- ke všem fázovým změnám dochází při současné změně energie.
- všechny fázové změny jsou izotermické.
- jaký je rozdíl mezi tavením a tuhnutím?
- jaký je rozdíl mezi varem a kondenzací?
- popište molekulární změny, když se pevná látka stává kapalinou.
- popište molekulární změny, když se kapalina stane plynem.
- jaká je změna energie, když se 78,0 g Hg roztaví při -38,8°c?
- jaká je změna energie, když 30,8 g Al ztuhne při 660°c?
- jaká je změna energie, když se 111 g Br2 vaří při 59,5°c?
- jaká je změna energie, když 98,6 g H2O kondenzuje při 100°C?
- každý z následujících příkazů je nesprávný. Přepište je tak, aby byly správné.
- změny teploty během změny fáze.
- proces, kdy se kapalina stává plynem, se nazývá sublimace.
- každé z následujících prohlášení je nesprávné. Přepište je tak, aby byly správné.
- objem plynu obsahuje pouze asi 10% hmoty, zbytek je prázdný prostor.
- ΔHsub se rovná ΔHvap.
- napište chemickou rovnici pro tavení elementárního sodíku.
- napište chemickou rovnici pro tuhnutí benzenu (C6H6).
- napište chemickou rovnici pro sublimaci CO2.
- napište chemickou rovnici pro varu propanolu (C3H7OH).
- jaký je ΔHsub H2O? (Tip: viz tabulka 10.2 „entalpie fúze pro různé látky“ a tabulka 10.3 „entalpie odpařování pro různé látky“.)
- ΔHsub I2 je 60,46 kJ / mol, zatímco jeho ΔHvap je 41,71 kJ / mol. Jaký je ΔHfus I2?
odpovědi
- tavení je fázová změna z pevné látky na kapalinu, zatímco tuhnutí je fázová změna z kapaliny na pevnou látku.
- molekuly mají dostatek energie, aby se pohybovaly kolem sebe, ale ne natolik, aby se od sebe úplně oddělily.
- 890 J.
- 10.7 kJ
-
- teplota se během změny fáze nemění.
- proces, kdy se kapalina stává plynem, se nazývá varu; proces, kdy se pevná látka stává plynem, se nazývá sublimace.
- na (s) → na (ℓ)
- CO2 (s) → CO2 (g)
- 46.69 kJ / mol