inzeráty:
tento článek vrhá světlo na šest faktorů ovlivňujících aktivitu enzymu.
šest faktorů je: (1) koncentrace enzymu (2) koncentrace substrátu (3) Vliv teploty (4) účinek pH (5) účinek koncentrace produktu a (6) účinek aktivátorů.
kontakt mezi enzymem a substrátem je nejdůležitějším předpokladem pro enzymatickou aktivitu.
inzeráty:
důležité faktory, které ovlivňují rychlost enzymové reakce, jsou diskutovány níže:
faktor # 1. Koncentrace enzymu:
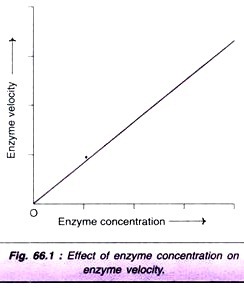
jak se koncentrace enzymu zvyšuje, rychlost reakce se úměrně zvyšuje (obr. 66.1). Ve skutečnosti se tato vlastnost enzymu používá při určování aktivity sérových enzymů pro diagnostiku onemocnění.
faktor č. 2. Koncentrace substrátu:
inzeráty:
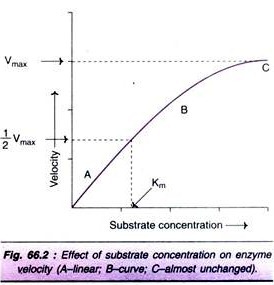
zvýšení koncentrace substrátu postupně zvyšuje rychlost enzymové reakce v omezeném rozsahu hladin substrátu. Obdélníková hyperbola se získá, když je rychlost vynesena proti koncentraci substrátu (obr. 66.2). V grafu jsou pozorovány tři odlišné fáze reakce.
kinetika enzymů a hodnota Km:
enzym (E) a substrát (y) se vzájemně kombinují a vytvářejí nestabilní komplex enzym-substrát (ES) pro tvorbu produktu (P).
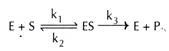
zde K1, k2 a k3 představují rychlostní konstanty pro příslušné reakce, jak je indikováno šipkami.
Km, Michaelisova-Mentenova konstanta (nebo Brigova a Haldanova konstanta), je dána vzorcem
![]()
následující rovnice se získá po vhodné algebraické manipulaci.
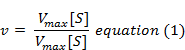
kde v = měřená rychlost,
Vmax = maximální rychlost,
S = koncentrace substrátu,
Km = Michaelis-Mentenova konstanta.
inzeráty:
Km nebo Michaelisova-Mentenova konstanta je definována jako koncentrace substrátu (vyjádřená v molech / lit) za vzniku poloviční maximální rychlosti v enzymaticky katalyzované reakci. 50%) jsou vázány s molekulami substrátu, když se koncentrace substrátu rovná hodnotě Km.
hodnota Km je konstantní a charakteristický rys daného enzymu. Je to zástupce pro měření pevnosti komplexu ES. Nízká hodnota Km označuje silnou afinitu mezi enzymem a substrátem, zatímco vysoká hodnota Km odráží slabou afinitu mezi nimi. U většiny enzymů jsou hodnoty Km v rozmezí 10-5 až 10-2 molů.
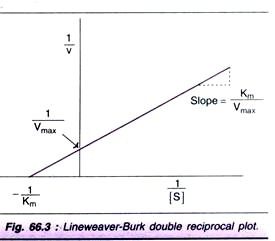
linka weaver-Burk double reciproční plot:
inzeráty:
pro stanovení hodnoty Km je křivka saturace substrátu (obr. 66.2) není příliš přesný, protože k Vmax se přistupuje asymptoticky. Přijetím reciprocálů rovnice (1)se získá přímé grafické znázornění.
řádek weaver-Burk graf je znázorněn na obr. 66.3. Je mnohem snazší vypočítat Km od zachycení na ose x, která je – (1 / Km). Dále je dvojitý reciproční děj užitečný při pochopení účinku různých zábran.
faktor č. 3. Vliv teploty:
Rychlost enzymové reakce se zvyšuje se zvýšením teploty až na maximum a poté klesá. Obvykle je pozorována křivka ve tvaru zvonu (obr. 66.4).
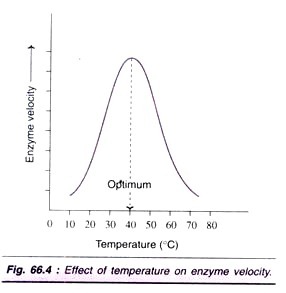
optimální teplota pro většinu enzymů je mezi 40°C-45°C. Jed fosfokinázy, svalová adenylát kináza) jsou aktivní i při 100°C. obecně platí, že když jsou enzymy vystaveny teplotě nad 50°C, je pozorována denaturace vedoucí k narušení nativní (terciární) struktury proteinu a aktivního místa. Většina enzymů se stává neaktivní při vyšší teplotě (nad 70°C).
faktor # 4. Účinek pH:
zvýšení koncentrace vodíkových iontů (pH) významně ovlivňuje aktivitu enzymu a normálně se získá zvonovitá křivka (obr. 66.5). Každý enzym má optimální pH, při kterém je maximální rychlost.
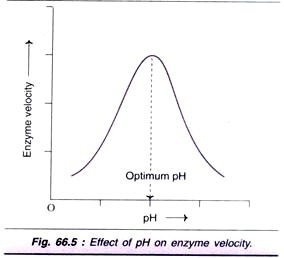
většina enzymů vyšších organismů vykazuje optimální aktivitu kolem neutrálního pH (6-8). Existuje však mnoho výjimek, jako je pepsin (1-2), kyselá fosfatáza (4-5) a alkalická fosfatáza (10-11) pro optimální pH.
faktor # 5. Účinek koncentrace produktu:
akumulace reakčních produktů obecně snižuje rychlost enzymu. U některých ‚ enzymů se produkty kombinují s aktivním místem enzymu a vytvářejí sypký komplex, a tím inhibují enzymatickou aktivitu. V živém systému je tomuto typu inhibice obecně zabráněno rychlým odstraněním vytvořených produktů.
faktor # 6. Účinek aktivátorů:
některé enzymy vyžadují určité anorganické kovové kationty jako Mg2+, Mn2+, Zn2+, Ca2+, Co2+, Cu2+, Na+, K + atd. pro jejich optimální aktivitu. Vzácně jsou anionty také potřebné pro enzymatickou aktivitu, např. chloridový iont (CI–) pro amylázu.