annoncer:
denne artikel kaster lys over de seks faktorer, der påvirker aktiviteten.
de seks faktorer er: (1) koncentration af substrat (2) koncentration af substrat (3) effekt af temperatur (4) effekt af pH (5) effekt af Produktkoncentration og (6) effekt af aktivatorer.
kontakten mellem substratet og substratet er den vigtigste forudsætning for aktiviteten.
reklamer:
de vigtige faktorer, der påvirker hastigheden af reaktionen, diskuteres nedenfor:
faktor # 1. Koncentration:
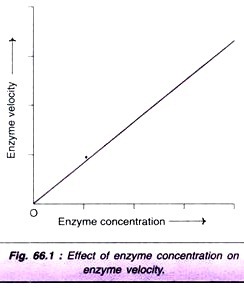
når koncentrationen øges, øges reaktionshastigheden proportionalt (Fig. 66.1). Faktisk bruges denne egenskab til at bestemme serumets aktiviteter til diagnosticering af sygdomme.
faktor # 2. Koncentration af substrat:
annoncer:
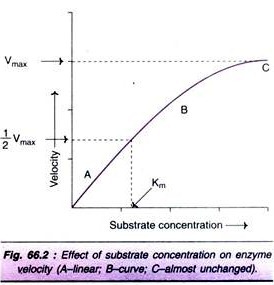
forøgelse af substratkoncentrationen øger gradvist hastigheden af reaktionen inden for det begrænsede område af substratniveauer. En rektangulær hyperbola opnås, når hastigheden afbildes mod substratkoncentrationen (Fig. 66.2). Tre forskellige faser af reaktionen observeres i grafen.
kinetik og Km-værdi:
substratet (E) og substratet (e) kombineres med hinanden for at danne et ustabilt kompleks (r) til dannelse af produkt (P).
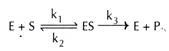
her repræsenterer k1, k2 og k3 hastighedskonstanterne for de respektive reaktioner, som angivet med pile.
Km, Michaelis-Menten-konstanten (eller Brig ‘ s og Haldanes konstant), er givet ved formlen
![]()
følgende ligning opnås efter passende algebraisk manipulation.
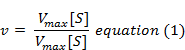
hvor V = målt hastighed,
Vmaks = maksimal hastighed,
S = Substratkoncentration,
Km = Michaelis-Menten konstant.
reklamer:
Km eller Michaelis-Menten-konstanten defineres som substratkoncentrationen (udtrykt i mol/lit) for at producere halv maksimal hastighed i en katalyseret reaktion. 50%) er bundet med substratmolekylerne, når substratkoncentrationen er lig med Km-værdien.
Km-værdi er et konstant og karakteristisk træk ved et givet ferment. Det er en repræsentant for måling af styrken af ES kompleks. En lav Km-værdi indikerer en stærk affinitet mellem substrat og substrat, mens en høj Km-værdi afspejler en svag affinitet mellem dem. Km-værdierne ligger i området fra 10-5 til 10-2 mol.
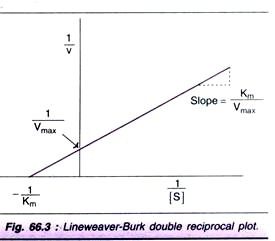
Linjevæver-Burk dobbelt gensidig plot:
annoncer:
til bestemmelse af Km-værdi er substratmætningskurven (Fig. 66.2) er ikke særlig nøjagtig, da Vmaks nærmer sig asymptotisk. Ved at tage reciprocals af ligningen (1) opnås en lige linje grafisk repræsentation.
Linjevæver-Burk-plottet er vist i Fig. 66.3. Det er meget lettere at beregne Km fra skæringspunktet på h-aksen, som er -(1/Km). Endvidere er det dobbelte gensidige plot nyttigt til at forstå effekten af forskellige hæmninger.
faktor # 3. Effekt af temperatur:
hastigheden af en reaktion øges med temperaturstigning op til et maksimum og falder derefter. En klokkeformet kurve observeres normalt (Fig. 66.4).
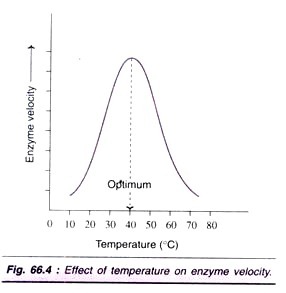
den optimale temperatur for de fleste af dem er mellem 40 liter C-45 liter C. Giftfosfokinaser, muskeladenylatkinase) er aktive selv ved 100 liter C. generelt ses denaturering, der fører til forstyrrelse i proteinets og det aktive steds native (tertiære) struktur. De fleste af dem bliver inaktive ved højere temperatur (over 70 liter C).
Faktor # 4. Effekt af pH:
forøgelse af hydrogenionkoncentrationen (pH) påvirker signifikant aktiviteten, og der opnås normalt en klokkeformet kurve (Fig. 66.5). Hver af dem har en optimal pH-værdi, hvor hastigheden er maksimal.
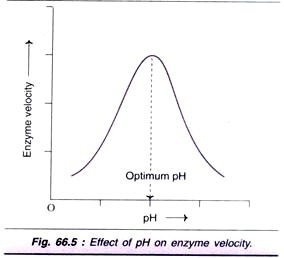
de fleste af de højere organismer viser optimal aktivitet omkring neutral pH (6-8). Der er dog mange undtagelser som pepsin (1-2), sur phosphatase (4-5) og alkalisk phosphatase (10-11) for optimal pH.
faktor # 5. Effekt af Produktkoncentration:
akkumuleringen af reaktionsprodukter reducerer generelt hastigheden. For visse produkter kombineres produkterne med det aktive sted og danner et løst kompleks og hæmmer således aktiviteten. I det levende system forhindres denne type hæmning generelt ved en hurtig fjernelse af dannede produkter.
faktor # 6. Effekt af aktivatorer:
nogle af dem kræver visse uorganiske metalliske kationer som Mg2+, Mn2+, SN2+, Ca2+, Co2+, Cu2+, Na+, K+ osv. for deres optimale aktivitet. I sjældne tilfælde er der også behov for anioner til f.eks. chloridion (CI–) til amylase.