Chapitre 10. Solides et Liquides
- Décrivez ce qui se passe lors d’un changement de phase.
- Calculez le changement d’énergie nécessaire pour un changement de phase.
Les substances peuvent changer de phase – souvent à cause d’un changement de température. À basse température, la plupart des substances sont solides; à mesure que la température augmente, elles deviennent liquides; à des températures encore plus élevées, ils deviennent gazeux.
Le processus de transformation d’un solide en liquide est appelé fusion (un terme plus ancien que vous pouvez parfois voir est fusion). Le processus inverse, un liquide devenant solide, est appelé solidification. Pour toute substance pure, la température à laquelle la fusion se produit — appelée point de fusion — est une caractéristique de cette substance. Il faut de l’énergie pour qu’un solide se fond dans un liquide. Chaque substance pure a une certaine quantité d’énergie dont elle a besoin pour passer d’un solide à un liquide. Cette quantité est appelée enthalpie de fusion (ou chaleur de fusion) de la substance, représentée par ΔHfus. Certaines valeurs de ΔHfus sont énumérées dans le Tableau 10.2 « Enthalpies de Fusion pour Diverses Substances »; on suppose que ces valeurs sont pour le point de fusion de la substance. Notez que l’unité de ΔHfus est le kilojoule par mole, nous avons donc besoin de connaître la quantité de matière pour savoir combien d’énergie est impliquée. Le ΔHfus est toujours tabulé comme un nombre positif. Cependant, il peut être utilisé à la fois pour les processus de fusion et de solidification à condition de garder à l’esprit que la fusion est toujours endothermique (donc ΔH sera positif), tandis que la solidification est toujours exothermique (donc ΔH sera négatif).
| Substance (Point de fusion) | ΔHfus (kJ/mol) |
|---|---|
| Eau (0°C) | 6.01 |
| Aluminium (660°C) | 10.7 |
| Benzène (5,5 °C) | 9.95 |
| Éthanol (-114,3°C) | 5.02 |
| Mercure (-38,8°C) | 2.29 |
Quel est le changement d’énergie lorsque 45,7 g de H2O fondent à 0°C?
Solution
Le ΔHfus de H2O est de 6,01 kJ/mol. Cependant, notre quantité est donnée en unités de grammes, pas en moles, la première étape consiste donc à convertir les grammes en moles en utilisant la masse molaire de H2O, qui est de 18,0 g / mol. Ensuite, nous pouvons utiliser ΔHfus comme facteur de conversion. Parce que la substance fond, le processus est endothermique, donc le changement d’énergie aura un signe positif.
![]()
Sans signe, le nombre est supposé positif.
Testez-vous
Quel est le changement d’énergie lorsque 108 g de C6H6 gèlent à 5,5°C ?
Réponse
-13.8 L
Pendant la fusion, l’énergie sert exclusivement à changer la phase d’une substance; elle n’entre pas dans la modification de la température d’une substance. Par conséquent, la fusion est un processus isotherme car une substance reste à la même température. Ce n’est que lorsque toute une substance est fondue que toute énergie supplémentaire va changer sa température.
Que se passe-t-il lorsqu’un solide devient liquide ? Dans un solide, les particules individuelles sont collées en place car les forces intermoléculaires ne peuvent pas être surmontées par l’énergie des particules. Lorsque plus d’énergie est fournie (p. ex., en augmentant la température), il arrive un point où les particules ont assez d’énergie pour se déplacer mais pas assez d’énergie pour se séparer. C’est la phase liquide : les particules sont toujours en contact mais sont capables de se déplacer les unes autour des autres. Ceci explique pourquoi les liquides peuvent prendre la forme de leurs récipients: les particules se déplacent et, sous l’influence de la gravité, remplissent le volume le plus faible possible (sauf si le liquide est dans un environnement d’apesanteur – voir Figure 10.16 « Liquides et gravité »).

Le changement de phase entre un liquide et un gaz présente quelques similitudes avec le changement de phase entre un solide et un liquide. À une certaine température, les particules d’un liquide ont suffisamment d’énergie pour devenir un gaz. Le processus d’un liquide devenant un gaz est appelé ébullition (ou vaporisation), tandis que le processus d’un gaz devenant un liquide est appelé condensation. Cependant, contrairement au processus de conversion solide / liquide, le processus de conversion liquide / gaz est sensiblement affecté par la pression environnante sur le liquide car les gaz sont fortement affectés par la pression. Cela signifie que la température à laquelle un liquide devient un gaz, le point d’ébullition, peut changer avec la pression environnante. Par conséquent, nous définissons le point d’ébullition normal comme la température à laquelle un liquide se transforme en gaz lorsque la pression environnante est exactement de 1 atm, ou 760 torr. Sauf indication contraire, on suppose qu’un point d’ébullition est pour 1 atm de pression.
Comme le changement de phase solide / liquide, le changement de phase liquide / gaz implique de l’énergie. La quantité d’énergie nécessaire pour convertir un liquide en gaz est appelée enthalpie de vaporisation (ou chaleur de vaporisation), représentée par ΔHvap. Certaines valeurs de ΔHvap sont énumérées dans le Tableau 10.3 « Enthalpies de vaporisation pour Diverses Substances »; on suppose que ces valeurs correspondent à la température normale du point d’ébullition de la substance, qui est également donnée dans le tableau. L’unité de ΔHvap est également de kilojoules par mole, nous avons donc besoin de connaître la quantité de matière pour savoir combien d’énergie est impliquée. Le ΔHvap est également toujours tabulé comme un nombre positif. Il peut être utilisé pour les processus d’ébullition et de condensation tant que vous gardez à l’esprit que l’ébullition est toujours endothermique (donc ΔH sera positif), tandis que la condensation est toujours exothermique (donc ΔH sera négatif).
| Substance (Point d’Ébullition Normal) | ΔHvap (kJ/mol) |
|---|---|
| Eau (100°C) | 40.68 |
| Brome (59,5°C) | 15.4 |
| Benzène (80,1°C) | 30.8 |
| Éthanol (78,3°C) | 38.6 |
| Mercure (357°C) | 59.23 |
Quel est le changement d’énergie lorsque 66,7 g de Br2 (g) se condensent en un liquide à 59,5 °C?
Solution
Le ΔHvap de Br2 est de 15,4 kJ/mol. Même s’il s’agit d’un processus de condensation, nous pouvons toujours utiliser la valeur numérique de ΔHvap tant que nous réalisons que nous devons retirer de l’énergie, de sorte que la valeur ΔH sera négative. Pour déterminer l’ampleur du changement d’énergie, nous devons d’abord convertir la quantité de Br2 en moles. Ensuite, nous pouvons utiliser ΔHvap comme facteur de conversion.
![]()
Le processus étant exothermique, la valeur réelle sera négative : ΔH = -6,43 kJ.
Testez-vous
Quel est le changement d’énergie lorsque 822 g de C2H5OH (ℓ) bouillent à son point d’ébullition normal de 78,3 °C?
Réponse
689 kJ
Comme pour la fusion, l’énergie en ébullition sert exclusivement à changer la phase d’une substance; elle n’entre pas dans la modification de la température d’une substance. L’ébullition est donc également un processus isotherme. Ce n’est que lorsque toute une substance a bouilli que toute énergie supplémentaire va changer sa température.
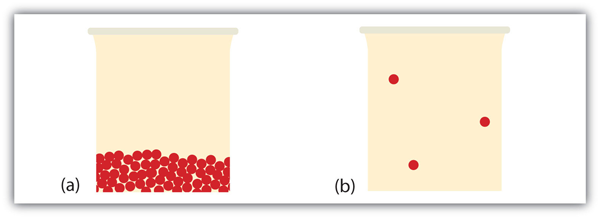
Que se passe-t-il lorsqu’un liquide devient un gaz? Nous avons déjà établi qu’un liquide est composé de particules en contact les unes avec les autres. Lorsqu’un liquide devient un gaz, les particules se séparent les unes des autres, chaque particule suivant son propre chemin dans l’espace. C’est ainsi que les gaz ont tendance à remplir leurs récipients. En effet, dans la phase gazeuse, la majeure partie du volume est un espace vide; seulement environ un millième du volume est effectivement absorbé par la matière (voir Figure 10.17 « Liquides et gaz »). C’est cette propriété des gaz qui explique pourquoi ils peuvent être comprimés, ce qui est considéré au chapitre 6 « Gaz ».
Dans certaines circonstances, la phase solide peut passer directement à la phase gazeuse sans passer par une phase liquide, et un gaz peut devenir directement un solide. Le changement solide-gaz est appelé sublimation, tandis que le processus inverse est appelé dépôt. La sublimation est isotherme, comme les autres changements de phase. Il y a un changement d’énergie mesurable pendant la sublimation; ce changement d’énergie est appelé l’enthalpie de sublimation, représentée par ΔHsub. La relation entre le ΔHsub et les autres changements d’enthalpie est la suivante:
ΔHsub = ΔHfus + ΔHvap
En tant que tel, ΔHsub n’est pas toujours tabulé car il peut être simplement calculé à partir de ΔHfus et ΔHvap.
Il existe plusieurs exemples courants de sublimation. Un produit bien connu — la glace carbonique – est en fait du CO2 solide. La glace carbonique est sèche car elle se sublime, le solide contournant la phase liquide et allant directement à la phase gazeuse. La sublimation se produit à une température de -77 ° C, elle doit donc être manipulée avec prudence. Si vous avez déjà remarqué que les glaçons dans un congélateur ont tendance à diminuer avec le temps, c’est parce que l’eau solide se sublime très lentement. La « brûlure au congélateur » n’est pas en fait une brûlure; elle se produit lorsque certains aliments, tels que les viandes, perdent lentement leur teneur en eau solide à cause de la sublimation. La nourriture est toujours bonne mais semble peu appétissante. Réduire la température d’un congélateur ralentira la sublimation de l’eau solide.
Les équations chimiques peuvent être utilisées pour représenter un changement de phase. Dans de tels cas, il est crucial d’utiliser des étiquettes de phase sur les substances. Par exemple, l’équation chimique pour la fusion de la glace pour produire de l’eau liquide est la suivante:
H2O(s) → H2O(ℓ)
Aucun changement chimique n’a lieu; cependant, un changement physique a lieu.
Courbes de chauffage
Un graphique de la température par rapport à la quantité de chaleur ajoutée est connu sous le nom de courbe de chauffage (voir Figure 10.18). Ceux-ci sont couramment utilisés pour montrer visuellement la relation entre les changements de phase et l’enthalpie pour une substance donnée.
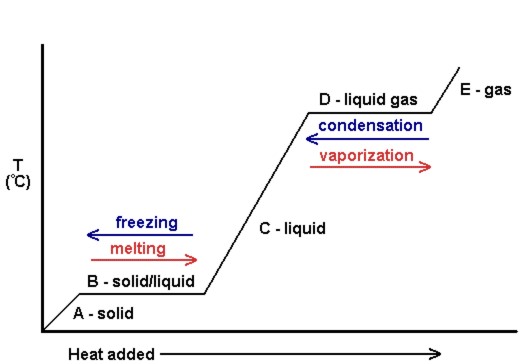
Dans la figure 10.18, le solide gagne en énergie cinétique et augmente par conséquent en température lorsque de la chaleur est ajoutée. Au point de fusion, la chaleur ajoutée est utilisée pour briser les forces intermoléculaires attrayantes du solide au lieu d’augmenter l’énergie cinétique, et donc la température reste constante. Une fois que tout le solide a fondu, une fois de plus, la chaleur ajoutée augmente l’énergie cinétique (et la température) des molécules liquides jusqu’au point d’ébullition. Au point d’ébullition, encore une fois, la chaleur ajoutée est utilisée pour briser les forces intermoléculaires attrayantes au lieu de fournir de l’énergie cinétique, et la température reste constante jusqu’à ce que tout le liquide ait été transformé en gaz.
- Des changements de phase peuvent se produire entre deux phases quelconques de la matière.
- Tous les changements de phase se produisent avec un changement simultané d’énergie.
- Tous les changements de phase sont isothermes.
- Quelle est la différence entre la fusion et la solidification?
- Quelle est la différence entre l’ébullition et la condensation?
- Décrire les changements moléculaires lorsqu’un solide devient liquide.
- Décrire les changements moléculaires lorsqu’un liquide devient un gaz.
- Quelle est la variation d’énergie lorsque 78,0 g de Hg fondent à -38,8°C?
- Quel est le changement d’énergie lorsque 30,8 g d’Al se solidifient à 660°C?
- Quel est le changement d’énergie lorsque 111 g de Br2 bouillent à 59,5°C?
- Quel est le changement d’énergie lorsque 98,6 g de H2O se condensent à 100°C?
- Chacune des instructions suivantes est incorrecte. Réécrivez-les pour qu’ils soient corrects.
- Changements de température lors d’un changement de phase.
- Le processus de transformation d’un liquide en gaz est appelé sublimation.
- Chacune des déclarations suivantes est incorrecte. Réécrivez-les pour qu’ils soient corrects.
- Le volume d’un gaz ne contient qu’environ 10% de matière, le reste étant de l’espace vide.
- ΔHsub est égal à ΔHvap.
- Écrivez l’équation chimique pour la fusion du sodium élémentaire.
- Écrivez l’équation chimique pour la solidification du benzène (C6H6).
- Écrivez l’équation chimique pour la sublimation du CO2.
- Écrivez l’équation chimique pour l’ébullition du propanol (C3H7OH).
- Quel est le ΔHsub de H2O? (Indice : voir Tableau 10.2 « Enthalpies de Fusion pour Diverses Substances » et Tableau 10.3 « Enthalpies de Vaporisation pour Diverses Substances ».)
- Le ΔHsub de I2 est de 60,46 kJ/mol, tandis que son ΔHvap est de 41,71 kJ/mol. Quel est le ΔHfus de I2?
Réponses
- La fusion est le changement de phase d’un solide à un liquide, tandis que la solidification est le changement de phase d’un liquide à un solide.
- Les molécules ont assez d’énergie pour se déplacer les unes sur les autres mais pas assez pour se séparer complètement les unes des autres.
- 890 J
- 10.7 JJ
-
- La température ne change pas lors d’un changement de phase.
- Le processus d’un liquide devenant un gaz est appelé ébullition; le processus d’un solide devenant un gaz est appelé sublimation.
- N(s) → N (ℓ)
- CO2 (s) → CO2 (g))
- 46.69 kJ/ mol