Capitolul 10. Solide și lichide
- descrieți ce se întâmplă în timpul unei schimbări de fază.
- calculați schimbarea de energie necesară pentru o schimbare de fază.
substanțele pot schimba faza — adesea din cauza unei schimbări de temperatură. La temperaturi scăzute, majoritatea substanțelor sunt solide; pe măsură ce temperatura crește, ele devin lichide; la temperaturi mai ridicate, ele devin gazoase.
procesul unui solid care devine lichid se numește topire (un termen mai vechi pe care îl puteți vedea uneori este fuziune). Procesul opus, un lichid care devine solid, se numește solidificare. Pentru orice substanță pură, temperatura la care are loc topirea — cunoscută sub numele de punct de topire — este o caracteristică a acelei substanțe. Este nevoie de energie pentru ca un solid să se topească într-un lichid. Fiecare substanță pură are o anumită cantitate de energie de care are nevoie pentru a trece de la un solid la un lichid. Această cantitate se numește entalpia fuziunii (sau a căldurii de fuziune) a substanței, reprezentată ca xff. Unele valori ale CIFF sunt enumerate în tabelul 10.2 „Entalpii de fuziune pentru diferite substanțe”; se presupune că aceste valori sunt pentru punctul de topire al substanței. Rețineți că unitatea de xff este kilojouli pe mol, deci trebuie să cunoaștem cantitatea de material pentru a ști câtă energie este implicată. Numărul de cifre al Cif este întotdeauna tabelat ca număr pozitiv. Cu toate acestea, poate fi folosit atât pentru procesele de topire, cât și pentru procesele de solidificare, atâta timp cât țineți cont de faptul că topirea este întotdeauna endotermică (deci XTX va fi pozitivă), în timp ce solidificarea este întotdeauna exotermă (deci XTX va fi negativă).
| substanță(punct de topire) | ) |
|---|---|
| apă (0 CTF C) | 6.01 |
| aluminiu (660 C) | 10.7 |
| benzen (5,5 XCT) | 9.95 |
| etanol (-114,3 Nox C) | 5.02 |
| Mercur (-38.8 inkt. C) | 2.29 |
care este schimbarea de energie atunci când 45,7 g de H2O se topesc la 0 centimetric C?
soluție
xff pentru H2O este de 6,01 kJ/mol. Cu toate acestea, cantitatea noastră este dată în unități de grame, nu alunițe, deci primul pas este să convertim grame în alunițe folosind masa molară a H2O, care este de 18,0 g/mol. Apoi, putem folosi ca factor de conversie un factor de conversie. Deoarece substanța se topește, procesul este endotermic, astfel încât schimbarea energiei va avea un semn pozitiv.
![]()
fără un semn, se presupune că numărul este pozitiv.
Testați-vă
care este schimbarea de energie atunci când 108 g de C6H6 îngheață la 5,5 CTC?
răspuns
-13.8 kJ
în timpul topirii, energia merge exclusiv la schimbarea fazei unei substanțe; nu intră în schimbarea temperaturii unei substanțe. Prin urmare, topirea este un proces izotermic, deoarece o substanță rămâne la aceeași temperatură. Numai atunci când toată o substanță este topită, orice energie suplimentară merge la schimbarea temperaturii sale.
ce se întâmplă când un solid devine lichid? Într-un solid, particulele individuale sunt blocate în loc, deoarece forțele intermoleculare nu pot fi depășite de energia particulelor. Când se furnizează mai multă energie (de ex., prin creșterea temperaturii), vine un punct în care particulele au suficientă energie pentru a se deplasa, dar nu suficientă energie pentru a se separa. Aceasta este faza lichidă: particulele sunt încă în contact, dar sunt capabile să se miște una în jurul celeilalte. Acest lucru explică de ce lichidele își pot asuma forma recipientelor: particulele se mișcă și, sub influența gravitației, umple cel mai mic volum posibil (cu excepția cazului în care lichidul se află într-un mediu cu gravitație zero — vezi figura 10.16 „lichide și gravitație”).

schimbarea de fază dintre un lichid și un gaz are unele asemănări cu schimbarea de fază dintre un solid și un lichid. La o anumită temperatură, particulele dintr-un lichid au suficientă energie pentru a deveni un gaz. Procesul unui lichid care devine gaz se numește fierbere (sau vaporizare), în timp ce procesul unui gaz care devine lichid se numește condensare. Cu toate acestea, spre deosebire de procesul de conversie solid/lichid, procesul de conversie lichid/gaz este afectat în mod vizibil de presiunea înconjurătoare asupra lichidului, deoarece gazele sunt puternic afectate de presiune. Aceasta înseamnă că temperatura la care un lichid devine un gaz, punctul de fierbere, se poate schimba cu presiunea înconjurătoare. Prin urmare, definim punctul normal de fierbere ca temperatura la care un lichid se schimbă într-un gaz atunci când presiunea înconjurătoare este exact 1 atm sau 760 torr. Dacă nu se specifică altfel, se presupune că un punct de fierbere este de 1 atm de presiune.
ca și schimbarea fazei solide / lichide, schimbarea fazei lichide / gazoase implică energie. Cantitatea de energie necesară pentru a converti un lichid într-un gaz se numește Entalpie de vaporizare (sau căldură de vaporizare), reprezentată ca Unquhvap. Unele ΔHvap valori sunt prezentate în Tabelul 10.3 „Entalpiile de Vaporizare pentru Diferite Substanțe”; se presupune că aceste valori sunt pentru temperatura normală a punctului de fierbere al substanței, care este de asemenea prezentată în tabel. Unitatea pentru Centihvap este, de asemenea, kilojouli pe mol, deci trebuie să cunoaștem cantitatea de material pentru a ști câtă energie este implicată. De asemenea, este întotdeauna tabelat ca un număr pozitiv. Poate fi folosit atât pentru procesele de fierbere, cât și pentru procesele de condensare, atâta timp cât țineți cont de faptul că fierberea este întotdeauna endotermică (deci, XTOXH va fi pozitivă), în timp ce condensarea este întotdeauna exotermă (deci XTOXH va fi negativă).
| substanță (punct normal de fierbere) | OLX (kJ / mol) |
|---|---|
| apa (100 C) | 40.68 |
| Brom (59,5 Nox C) | 15.4 |
| benzen (80,1 CTF) | 30.8 |
| etanol (78,3 Nox C) | 38.6 |
| Mercur (357 Inqu C) | 59.23 |
care este schimbarea de energie atunci când 66,7 g de Br2(g) se condensează într-un lichid la 59,5 centi C?
soluție
valoarea Xvap a Br2 este de 15,4 kJ/mol. Chiar dacă acesta este un proces de condensare, putem folosi în continuare valoarea numerică a lui Xvhvap, atâta timp cât ne dăm seama că trebuie să scoatem energie, astfel încât valoarea lui XVH va fi negativă. Pentru a determina magnitudinea schimbării energiei, trebuie mai întâi să convertim cantitatea de Br2 în moli. Apoi, putem folosi ca un factor de conversie de la Xvhvap.
![]()
deoarece procesul este exoterm, valoarea reală va fi negativă: -6,43 KJ.
Testați-vă
care este schimbarea de energie atunci când 822 g de C2H5OH(XV) se fierbe la punctul său normal de fierbere de 78,3 cmc?
răspuns
689 kJ
ca și în cazul topirii, energia în fierbere merge exclusiv la schimbarea fazei unei substanțe; nu intră în schimbarea temperaturii unei substanțe. Deci fierberea este, de asemenea, un proces izotermic. Numai atunci când toată o substanță a fiert, orice energie suplimentară merge la schimbarea temperaturii sale.
ce se întâmplă când un lichid devine gaz? Am stabilit deja că un lichid este compus din particule în contact între ele. Când un lichid devine gaz, particulele se separă unele de altele, fiecare particulă mergând pe drumul său în spațiu. Acesta este modul în care gazele tind să-și umple recipientele. Într-adevăr, în faza gazoasă, cea mai mare parte a volumului este spațiu gol; doar aproximativ o miime din volum este de fapt preluată de materie (a se vedea figura 10.17 „lichide și gaze”). Această proprietate a gazelor explică de ce pot fi comprimate, fapt care este considerat în Capitolul 6 „gaze”.
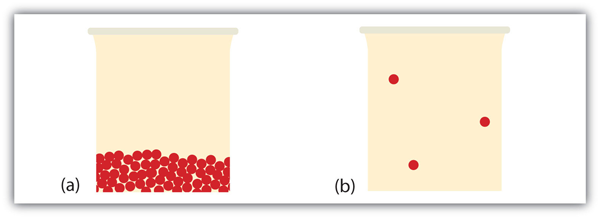
în anumite circumstanțe, faza solidă poate trece direct la faza gazoasă fără a trece printr-o fază lichidă, iar un gaz poate deveni direct solid. Schimbarea solid-gaz se numește sublimare, în timp ce procesul invers se numește depunere. Sublimarea este Izotermă, ca și celelalte schimbări de fază. Există o schimbare de energie măsurabilă în timpul sublimării; această schimbare de energie se numește Entalpie de sublimare, reprezentată ca. Relația dintre modificările de entalpie și celelalte entalpii este după cum urmează:
ΔHsub = ΔHfus + ΔHvap
Ca atare, ΔHsub nu este întotdeauna intabulat, deoarece acesta poate fi pur și simplu de calculat de la ΔHfus și ΔHvap.
există câteva exemple comune de sublimare. Un produs bine cunoscut — gheața uscată-este de fapt CO2 solid. Gheața uscată este uscată deoarece sublimează, solidul ocolind faza lichidă și trecând direct la faza gazoasă. Sublimarea are loc la temperatura de -77 centimetric C, deci trebuie manipulată cu precauție. Dacă ați observat vreodată că cuburile de gheață dintr-un congelator tind să se micșoreze în timp, se datorează faptului că apa solidă se sublimează foarte încet. „Arderea congelatorului” nu este de fapt o arsură; apare atunci când anumite alimente, cum ar fi carnea, pierd încet conținutul de Apă solidă din cauza sublimării. Mâncarea este încă bună, dar pare neapetisantă. Reducerea temperaturii unui congelator va încetini sublimarea apei solide.
ecuațiile chimice pot fi folosite pentru a reprezenta o schimbare de fază. În astfel de cazuri, este esențial să se utilizeze etichete de fază pe substanțe. De exemplu, ecuația chimică pentru topirea gheții pentru a produce apă lichidă este după cum urmează:
H2O(s) H2O(sec)
nu are loc nicio schimbare chimică; cu toate acestea, are loc o schimbare fizică.
curbe de încălzire
un grafic al temperaturii față de cantitatea de căldură adăugată este cunoscut sub numele de curbă de încălzire (a se vedea figura 10.18). Acestea sunt utilizate în mod obișnuit pentru a arăta vizual relația dintre schimbările de fază și entalpia pentru o anumită substanță.
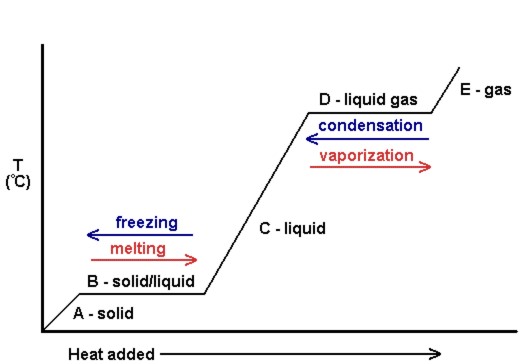
în figura 10.18, solidul câștigă energie cinetică și, prin urmare, crește temperatura pe măsură ce se adaugă căldură. La punctul de topire, căldura adăugată este utilizată pentru a rupe forțele intermoleculare atractive ale solidului în loc să crească energia cinetică și, prin urmare, temperatura rămâne constantă. După ce tot solidul s-a topit, încă o dată, căldura adăugată duce la creșterea energiei cinetice (și a temperaturii) moleculelor lichide până la punctul de fierbere. La punctul de fierbere, încă o dată, căldura adăugată este utilizată pentru a rupe forțele intermoleculare atractive în loc să furnizeze energie cinetică, iar temperatura rămâne constantă până când tot lichidul a fost transformat în gaz.
- schimbările de fază pot apărea între oricare două faze ale materiei.
- toate schimbările de fază apar cu o schimbare simultană a energiei.
- toate schimbările de fază sunt izoterme.
- care este diferența dintre topire și solidificare?
- care este diferența dintre fierbere și condensare?
- descrie modificările moleculare atunci când un solid devine lichid.
- descrie modificările moleculare atunci când un lichid devine gaz.
- care este schimbarea de energie atunci când 78,0 g de Hg se topesc la -38,8 ct?
- care este schimbarea de energie atunci când 30,8 g de Al se solidifică la 660 ct?
- care este schimbarea de energie atunci când 111 g de Br2 fierbe la 59,5 centimetrii c?
- care este schimbarea energiei atunci când 98,6 g de H2O se condensează la 100 de centimetrii?
- fiecare dintre următoarele afirmații este incorectă. Rescrieți-le astfel încât să fie corecte.
- schimbările de temperatură în timpul unei schimbări de fază.
- procesul de transformare a unui lichid într-un gaz se numește sublimare.
- fiecare dintre următoarele afirmații este incorectă. Rescrieți-le astfel încât să fie corecte.
- volumul unui gaz conține doar aproximativ 10% materie, restul fiind spațiu gol.
- Xlxsub este egal cu Xlxxvap.
- scrieți ecuația chimică pentru topirea sodiului elementar.
- scrieți ecuația chimică pentru solidificarea benzenului (C6H6).
- scrieți ecuația chimică pentru sublimarea CO2.
- scrieți ecuația chimică pentru fierberea propanolului (C3H7OH).
- care este valoarea X-X A H2O? (Sugestie: a se vedea tabelul 10.2 „Entalpii de fuziune pentru diferite substanțe” și tabelul 10.3 „Entalpii de vaporizare pentru diferite substanțe”.)
- valoarea lui I2 este de 60,46 kJ/mol, în timp ce valoarea lui 41,71 kJ/mol. Ce este I2-ul de la I2?
răspunsuri
- topirea este schimbarea de fază de la un solid la un lichid, în timp ce solidificarea este schimbarea de fază de la un lichid la un solid.
- moleculele au suficientă energie pentru a se mișca una în jurul celeilalte, dar nu suficientă pentru a se separa complet una de cealaltă.
- 890 J
- 10.7 kJ
-
- temperatura nu se schimbă în timpul unei schimbări de fază.
- procesul unui lichid care devine gaz se numește fierbere; procesul unui solid care devine gaz se numește sublimare.
- Na (e) na (e))
- CO2(i) CO2(i))
- 46.69 kJ / mol