Kapitel 10. Fasta ämnen och vätskor
- beskriv vad som händer under en fasförändring.
- beräkna den energiförändring som behövs för en fasförändring.
ämnen kan ändra fas-ofta på grund av en temperaturförändring. Vid låga temperaturer är de flesta ämnen fasta; när temperaturen ökar blir de flytande; vid högre temperaturer blir de fortfarande gasformiga.
processen med att ett fast ämne blir en vätska kallas smältning (en äldre term som du ibland kan se är fusion). Den motsatta processen, en vätska som blir en fast substans, kallas stelning. För varje ren substans är temperaturen vid vilken smältning sker-känd som smältpunkten — ett kännetecken för det ämnet. Det kräver energi för att ett fast ämne ska smälta i en vätska. Varje ren substans har en viss mängd energi som den behöver byta från ett fast ämne till en vätska. Denna mängd kallas fusionens entalpi (eller fusionsvärme) av substansen, representerad som Enthalpy. Vissa värden i enlighet med denna tabell anges i tabell 10.2 ”Fusionsentalpier för olika ämnen”; det antas att dessa värden är för ämnets smältpunkt. Observera att enheten för Ubihfus är kilojoule per mol, så vi behöver veta mängden material för att veta hur mycket energi som är inblandad. I tabellform är det alltid ett positivt tal. Det kan dock användas för både smältning och stelningsprocesser så länge du kommer ihåg att smältning alltid är endoterm (så att sackaros kommer att vara positiv), medan stelning alltid är exoterm (så kakaros kommer att vara negativ).
| ämne (Smältpunkt) | ) |
|---|---|
| vatten (0) | 6.01 |
| aluminium (660 C) | 10.7 |
| bensen (5,5 CCB) | 9.95 |
| etanol (-114,3 C) | 5.02 |
| kvicksilver (-38,8 C) | 2.29 |
vad är energiförändringen när 45,7 g H2O smälter vid 0 kcal C?
lösning
H2o är 6,01 kJ/mol. Men vår kvantitet ges i enheter av gram, inte mol, så det första steget är att konvertera gram till mol med hjälp av molmassan H2O, som är 18,0 g/mol. Då kan vi använda oss av en konverteringsfaktor. Eftersom ämnet smälter är processen endoterm, så energiförändringen kommer att ha ett positivt tecken.
![]()
utan ett tecken antas numret vara positivt.
testa dig själv
Vad är energiförändringen när 108 g C6H6 fryser vid 5, 5 kcal C?
svar
-13.8 kJ
under smältning går energi uteslutande till att ändra fasen av ett ämne; Det går inte att ändra temperaturen på ett ämne. Smältning är därför en isotermisk process eftersom ett ämne stannar vid samma temperatur. Först när allt ämne smälts går någon extra energi till att ändra temperaturen.
vad händer när ett fast ämne blir en vätska? I ett fast ämne fastnar enskilda partiklar på plats eftersom de intermolekylära krafterna inte kan övervinnas av partiklarnas energi. När mer energi tillförs (t. ex., genom att höja temperaturen) kommer det en punkt där partiklarna har tillräckligt med energi för att röra sig men inte tillräckligt med energi för att separera. Detta är vätskefasen: partiklar är fortfarande i kontakt men kan röra sig runt varandra. Detta förklarar varför vätskor kan anta formen på sina behållare: partiklarna rör sig runt och, under påverkan av tyngdkraften, fyller den lägsta möjliga volymen (såvida inte vätskan befinner sig i en tyngdkraftsmiljö-se figur 10.16 ”vätskor och gravitation”).

fasförändringen mellan en vätska och en gas har vissa likheter med fasförändringen mellan en fast och en vätska. Vid en viss temperatur har partiklarna i en vätska tillräckligt med energi för att bli en gas. Processen för en vätska som blir en gas kallas kokning (eller förångning), medan processen för en gas som blir en vätska kallas kondensation. Till skillnad från omvandlingsprocessen för fast/flytande påverkas emellertid omvandlingsprocessen för vätska/gas märkbart av det omgivande trycket på vätskan eftersom gaser påverkas starkt av tryck. Detta innebär att temperaturen vid vilken en vätska blir en gas, kokpunkten, kan förändras med omgivande tryck. Därför definierar vi den normala kokpunkten som temperaturen vid vilken en vätska ändras till en gas när det omgivande trycket är exakt 1 atm eller 760 torr. Om inte annat anges antas det att en kokpunkt är för 1 atm tryck.
liksom den fasta / flytande fasförändringen involverar flytande / gasfasförändringen energi. Den mängd energi som krävs för att omvandla en vätska till en gas kallas förångningens entalpi (eller förångningsvärme), representerad som Sighvap. Vissa värden för användning i tabell 10.3 ”Entalpier för förångning av olika ämnen”; det antas att dessa värden är för ämnets normala kokpunktstemperatur, vilket också anges i tabellen. Enheten för att göra detta är också kilojoule per mol, så vi behöver veta mängden material för att veta hur mycket energi som är inblandad. Det är också alltid tabellerat som ett positivt tal. Det kan användas för både kokning och kondensationsprocesser så länge du kommer ihåg att kokning alltid är endoterm (så att det blir positivt), medan kondens alltid är exoterm (så att det blir negativt).
| ämne (Normal kokpunkt) | ) |
|---|---|
| vatten (100) | 40.68 |
| brom (59,5) | 15.4 |
| bensen (80,1 C) | 30.8 |
| etanol (78,3 C) | 38.6 |
| kvicksilver (357) | 59.23 |
vad är energiförändringen när 66, 7 g Br2(g) kondenserar till en vätska vid 59, 5 kcal C?
lösning
BR2 är 15,4 kJ/mol. Även om detta är en kondenseringsprocess, kan vi fortfarande använda det numeriska värdet av Securitas så länge vi inser att vi måste ta ut energi, så Securitas värde kommer att vara negativt. För att bestämma storleken på energiförändringen måste vi först konvertera mängden Br2 till mol. Då kan vi använda oss av en konverteringsfaktor.
![]()
eftersom processen är exoterm, kommer det faktiska värdet att vara negativt: USC = -6,43 kJ.
testa dig själv
vad är energiförändringen när 822 g C2H5OH (POV) kokar vid sin normala kokpunkt på 78,3 C?
svar
689 kJ
som med smältning går energin i kokning uteslutande till att ändra fasen av ett ämne; Det går inte att ändra temperaturen på ett ämne. Så kokning är också en isotermisk process. Först när allt ämne har kokat går någon extra energi till att ändra temperaturen.
vad händer när en vätska blir en gas? Vi har redan fastställt att en vätska består av partiklar i kontakt med varandra. När en vätska blir en gas separeras partiklarna från varandra, med varje partikel som går sin egen väg i rymden. Så här tenderar gaser att fylla sina behållare. I gasfasen är det mesta av volymen tomt utrymme; endast ungefär en tusendel av volymen tas faktiskt upp av materia (se figur 10.17 ”vätskor och gaser”). Det är denna egenskap av gaser som förklarar varför de kan komprimeras, ett faktum som behandlas i kapitel 6 ”gaser”.
under vissa omständigheter kan den fasta fasen övergå direkt till gasfasen utan att gå igenom en vätskefas, och en gas kan direkt bli en fast substans. Fast-till-gas-förändringen kallas sublimering, medan den omvända processen kallas deponering. Sublimering är isotermisk, som de andra fasförändringarna. Det finns en mätbar energiförändring under sublimering; denna energiförändring kallas entalpi av sublimering, representerad som Avsugningsub. Förhållandet mellan entalpin och den andra entalpin förändras enligt följande:
ΔHsub = ΔHfus + ΔHvap
Som sådan, ΔHsub är inte alltid tabellform eftersom det kan vara enkelt beräknas från ΔHfus och ΔHvap.
det finns flera vanliga exempel på sublimering. En välkänd produkt-torris-är faktiskt fast CO2. Torris är torr eftersom den sublimerar, med det fasta ämnet som kringgår vätskefasen och går direkt till gasfasen. Sublimering sker vid en temperatur av -77 C. C., så det måste hanteras med försiktighet. Om du någonsin har märkt att isbitar i en frys tenderar att bli mindre med tiden beror det på att det fasta vattnet sublimerar mycket långsamt. ”Frysbränning” är inte en brännskada; det uppstår när vissa livsmedel, som kött, långsamt förlorar fast vattenhalt på grund av sublimering. Maten är fortfarande bra men ser oaptitlig ut. Att minska temperaturen på en frys kommer att sakta ner sublimeringen av fast vatten.
kemiska ekvationer kan användas för att representera en fasförändring. I sådana fall är det viktigt att använda fasetiketter på ämnena. Till exempel, den kemiska ekvationen för smältning av is för att göra flytande vatten är som följer:
H2O(s) portugueseh2o(Ukrainian)
ingen kemisk förändring äger rum; emellertid sker en fysisk förändring.
Värmekurvor
en plot av temperaturen kontra mängden tillsatt värme kallas en värmekurva (se figur 10.18). Dessa används ofta för att visuellt visa förhållandet mellan fasförändringar och entalpi för en given substans.
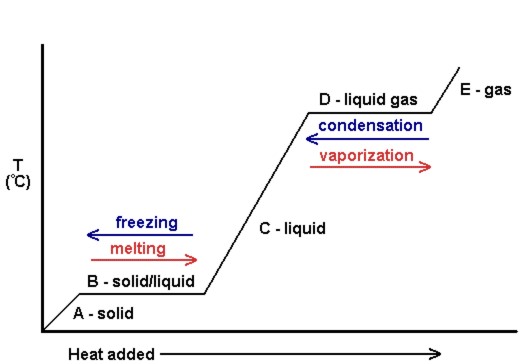
i Figur 10.18 får den fasta kinetiska energin och stiger följaktligen i temperatur när värme tillsätts. Vid smältpunkten används den tillsatta värmen för att bryta de attraktiva intermolekylära krafterna hos det fasta ämnet istället för att öka kinetisk energi, och därför förblir temperaturen konstant. När allt fast ämne har smält, går den tillsatta värmen till att öka den kinetiska energin (och temperaturen) hos de flytande molekylerna fram till kokpunkten. Vid kokpunkten används återigen den tillsatta värmen för att bryta de attraktiva intermolekylära krafterna istället för att tillföra kinetisk energi, och temperaturen förblir konstant tills all vätska har vridits till gas.
- fasförändringar kan inträffa mellan två faser av materia.
- alla fasförändringar sker med en samtidig energiförändring.
- alla fasförändringar är isotermiska.
- Vad är skillnaden mellan smältning och stelning?
- vad är skillnaden mellan kokning och kondens?
- beskriv molekylära förändringar när ett fast ämne blir en vätska.
- beskriv molekylära förändringar när en vätska blir en gas.
- vad är energiförändringen när 78,0 g Hg smälter vid -38,8 kcal C?
- vad är energiförändringen när 30, 8 g Al stelnar vid 660 kcal C?
- vad är energiförändringen när 111 g Br2 kokar vid 59,5 kcal C?
- vad är energiförändringen när 98,6 g H2O kondenserar vid 100 kcal C?
- var och en av följande påståenden är felaktiga. Skriv om dem så att de är korrekta.
- temperaturförändringar under en fasförändring.
- processen att en vätska blir en gas kallas sublimering.
- var och en av följande påståenden är felaktig. Skriv om dem så att de är korrekta.
- volymen av en gas innehåller endast cirka 10% materia, medan resten är tomt utrymme.
- Ubihsub är lika med Ubihvap.
- skriv den kemiska ekvationen för smältning av elementärt natrium.
- skriv den kemiska ekvationen för stelning av bensen (C6H6).
- skriv den kemiska ekvationen för sublimering av CO2.
- skriv den kemiska ekvationen för kokning av propanol (C3H7OH).
- Vad är H2o: s H2o? (Tips: Se tabell 10.2″ Entalpier av Fusion för olika ämnen ”och tabell 10.3″Entalpier av förångning för olika ämnen”.)
- I2 är 60,46 kJ/mol, medan dess I2 är 41,71 kJ/mol. Vad är I2: S I2?
svar
- smältning är fasförändringen från ett fast ämne till en vätska, medan stelning är fasförändringen från en vätska till ett fast ämne.
- molekylerna har tillräckligt med energi för att röra sig om varandra men inte tillräckligt för att helt skilja sig från varandra.
- 890 J
- 10.7 kJ
-
- temperaturen ändras inte under en fasförändring.
- processen för en vätska som blir en gas kallas kokning; processen för ett fast ämne som blir en gas kallas sublimering.
- Na(s))
- CO2 (s) ox. CO2 (g)
- 46.69 kJ / mol