Kapitel 10. Faste stoffer og væsker
- Beskriv hvad der sker under en faseændring.
- Beregn den energiændring, der er nødvendig for en faseændring.
stoffer kan ændre fase-ofte på grund af en temperaturændring. Ved lave temperaturer er de fleste stoffer faste; når temperaturen stiger, bliver de flydende; ved højere temperaturer bliver de stadig gasformige.
processen med, at et fast stof bliver en væske, kaldes smeltning (et ældre udtryk, som du måske ser nogle gange, er fusion). Den modsatte proces, en væske, der bliver et fast stof, kaldes størkning. For ethvert rent stof er den temperatur, ved hvilken smeltning forekommer — kendt som smeltepunktet — et kendetegn ved dette stof. Det kræver energi for et fast stof at smelte til en væske. Hvert rent stof har en vis mængde energi, det har brug for at skifte fra et fast stof til en væske. Denne mængde kaldes entalpi af fusion (eller fusionsvarme) af stoffet, repræsenteret som Lerhfus. Nogle af de værdier, der er anført i tabel 10.2 “Fusionsenthalpier for forskellige stoffer”; det antages, at disse værdier er for stoffets smeltepunkt. Bemærk, at enheden af Prishfus er kilojoules per mol, så vi skal vide mængden af materiale for at vide, hvor meget energi der er involveret. Det er altid et positivt tal. Det kan dog bruges til både smeltnings-og størkningsprocesserne, så længe du husker, at smeltning altid er endoterm (så lurt vil være positiv), mens størkning altid er eksoterm (så lurt vil være negativ).
| indholdsstof (smeltepunkt) | Larghfus (kJ / mol) |
|---|---|
| vand (0 liter C) | 6.01 |
| aluminium (660 liter C) | 10.7 |
| Bensene (5,5 g) | 9.95 |
| Ethanol (-114,3 kg C) | 5.02 |
| kviksølv (-38,8 kr) | 2.29 |
Hvad er energiændringen, når 45,7 g H2O smelter ved 0 liter C?
opløsning
H2O ‘ s Lyshfus er 6,01 kJ/mol. Imidlertid er vores mængde angivet i enheder af gram, ikke mol, så det første skridt er at konvertere gram til mol ved hjælp af den molære masse af H2O, som er 18,0 g/mol. Så kan vi bruge Prishfus som en konverteringsfaktor. Fordi stoffet smelter, er processen endoterm, så energiændringen vil have et positivt tegn.
![]()
uden et tegn antages antallet at være positivt.
Test dig selv
Hvad er energiændringen, når 108 g C6H6 fryser ved 5,5 liter C?
svar
-13.8 kJ
under smeltning går energi udelukkende til at ændre fasen af et stof; det går ikke ind i at ændre temperaturen på et stof. Derfor er smeltning en isotermisk proces, fordi et stof forbliver ved samme temperatur. Først når alt et stof er smeltet, går yderligere energi til at ændre temperaturen.
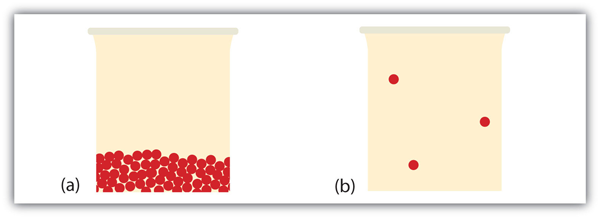
Hvad sker der, når et fast stof bliver en væske? I et fast stof sidder individuelle partikler fast på plads, fordi de intermolekylære kræfter ikke kan overvindes af partiklernes energi. Når der tilføres mere energi (f. eks., ved at hæve temperaturen) kommer der et punkt, hvor partiklerne har nok energi til at bevæge sig rundt, men ikke nok energi til at adskille. Dette er væskefasen: partikler er stadig i kontakt, men er i stand til at bevæge sig rundt om hinanden. Dette forklarer, hvorfor væsker kan antage formen på deres beholdere: partiklerne bevæger sig rundt og fylder under påvirkning af tyngdekraften det lavest mulige volumen (medmindre væsken er i et miljø med nul tyngdekraft-se figur 10.16 “væsker og tyngdekraft”).

faseændringen mellem en væske og en gas har nogle ligheder med faseændringen mellem et fast stof og en væske. Ved en bestemt temperatur har partiklerne i en væske nok energi til at blive en gas. Processen med, at en væske bliver en gas, kaldes kogning (eller vapourisering), mens processen med, at en gas bliver en væske, kaldes kondensation. I modsætning til den faste / flydende konverteringsproces påvirkes væske / gaskonverteringsprocessen imidlertid mærkbart af det omgivende tryk på væsken, fordi gasser er stærkt påvirket af tryk. Dette betyder, at temperaturen, ved hvilken en væske bliver en gas, kogepunktet, kan ændre sig med det omgivende tryk. Derfor definerer vi det normale kogepunkt som den temperatur, ved hvilken en væske ændres til en gas, når det omgivende tryk er nøjagtigt 1 atm eller 760 torr. Medmindre andet er angivet, antages det, at et kogepunkt er for 1 atm tryk.
ligesom fast/flydende faseændring involverer væske/gasfaseændring energi. Den mængde energi, der kræves for at omdanne en væske til en gas, kaldes fordampningens entalpi (eller fordampningsvarme), repræsenteret som Lerhvap. Nogle af de værdier, der er anført i tabel 10.3 “Enthalpier af fordampning for forskellige stoffer”; det antages, at disse værdier er for stoffets normale kogepunktstemperatur, som også er angivet i tabellen. Enheden til Larhvap er også kilojoules pr. mol, så vi skal vide mængden af materiale for at vide, hvor meget energi der er involveret. Den Prishvap er også altid tabuleret som et positivt tal. Det kan bruges til både kognings-og kondensationsprocesserne, så længe du husker, at kogning altid er endoterm (så LERTH vil være positiv), mens kondens altid er eksoterm (så LERTH vil være negativ).
| indholdsstof (normalt kogepunkt) | Larghvap (kJ / mol) |
|---|---|
| vand (100 Liter C) | 40.68 |
| brom (59,5 G C) | 15.4 |
| Bensene (80,1 kr) | 30.8 |
| Ethanol (78,3 kg C) | 38.6 |
| kviksølv (357 kr) | 59.23 |
Hvad er energiændringen, når 66,7 g Br2(g) kondenserer til en væske ved 59,5 liter C?
opløsning
Br2 ‘ s Lyshvap er 15,4 kJ/mol. Selv om dette er en kondensationsproces, kan vi stadig bruge den numeriske værdi af Prishvap, så længe vi er klar over, at vi skal tage energi ud, så PRISH-værdien vil være negativ. For at bestemme størrelsen af energiændringen skal vi først konvertere mængden af Br2 til mol. Så kan vi bruge Kurvvap som en konverteringsfaktor.
![]()
fordi processen er eksoterm, vil den faktiske værdi være negativ: liter = -6,43 kj.
Test dig selv
Hvad er energiændringen, når 822 g C2H5OH(liter) koger ved sit normale kogepunkt på 78,3 liter C?
svar
689 kJ
som ved smeltning går energien i kogning udelukkende til at ændre fasen af et stof; det går ikke ind i at ændre temperaturen på et stof. Så kogning er også en isotermisk proces. Først når alt et stof er kogt, går yderligere energi til at ændre temperaturen.
Hvad sker der, når en væske bliver en gas? Vi har allerede fastslået, at en væske består af partikler i kontakt med hinanden. Når en væske bliver en gas, adskiller partiklerne sig fra hinanden, hvor hver partikel går sin egen vej i rummet. Sådan har gasser tendens til at fylde deres containere. Faktisk er det meste af volumenet i gasfasen tomt rum; kun omkring en tusindedel af volumenet optages faktisk af stof (se figur 10.17 “væsker og gasser”). Det er denne egenskab af gasser, der forklarer, hvorfor de kan komprimeres, en kendsgerning, der overvejes i kapitel 6 “gasser”.
under nogle omstændigheder kan den faste fase overgå direkte til gasfasen uden at gå gennem en flydende fase, og en gas kan direkte blive et fast stof. Den faste til gasændring kaldes sublimering, mens den omvendte proces kaldes aflejring. Sublimering er isotermisk, ligesom de andre faseændringer. Der er en målbar energiændring under sublimering; denne energiændring kaldes sublimeringens entalpi, repræsenteret som Lushsub. Forholdet mellem Prichsub og de andre entalpiændringer er som følger:
ΔHsub = ΔHfus + ΔHvap
Som sådan, ΔHsub er ikke altid tabuleret, fordi det kan simpelthen beregnet ud fra ΔHfus og ΔHvap.
der er flere almindelige eksempler på sublimering. Et velkendt produkt-tøris – er faktisk fast CO2. Tøris er tør, fordi den sublimerer, hvor det faste stof omgår væskefasen og går direkte til gasfasen. Sublimeringen sker ved en temperatur på -77 liter C, så den skal håndteres med forsigtighed. Hvis du nogensinde har bemærket, at isterninger i en fryser har tendens til at blive mindre over tid, skyldes det, at det faste vand meget langsomt sublimerer. “Frysebrænding” er faktisk ikke en forbrænding; det opstår, når visse fødevarer, såsom kød, langsomt mister fast vandindhold på grund af sublimering. Maden er stadig god, men ser uappetitlig ud. At reducere temperaturen på en fryser vil bremse sublimeringen af fast vand.
kemiske ligninger kan bruges til at repræsentere en faseændring. I sådanne tilfælde er det afgørende at anvende faseetiketter på stofferne. For eksempel er den kemiske ligning for smeltning af is til fremstilling af flydende vand som følger:
H2O(s) liter H2O(liter)
ingen kemisk ændring finder sted; dog finder en fysisk ændring sted.
Varmekurver
et plot af temperaturen versus mængden af tilsat varme er kendt som en varmekurve (se figur 10.18). Disse bruges ofte til visuelt at vise forholdet mellem faseændringer og entalpi for et givet stof.
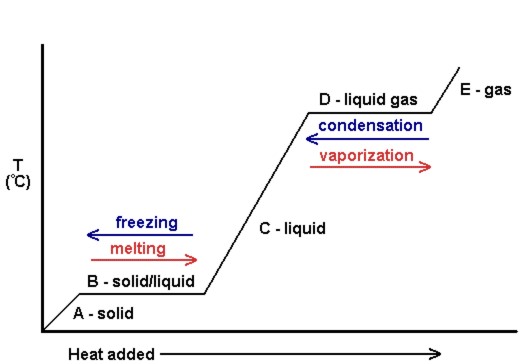
i figur 10.18 får det faste stof kinetisk energi og stiger følgelig i temperatur, når der tilsættes varme. Ved smeltepunktet bruges den tilsatte varme til at bryde de attraktive intermolekylære kræfter af det faste stof i stedet for at øge kinetisk energi, og derfor forbliver temperaturen konstant. Når alt det faste stof er smeltet, går den tilsatte varme igen til at øge den kinetiske energi (og temperaturen) af de flydende molekyler indtil kogepunktet. Ved kogepunktet bruges igen den tilsatte varme til at bryde de attraktive intermolekylære kræfter i stedet for at levere kinetisk energi, og temperaturen forbliver konstant, indtil al væske er blevet omdannet til gas.
- faseændringer kan forekomme mellem to faser af materie.
- alle faseændringer sker med en samtidig ændring i energi.
- alle faseændringer er isotermiske.
- Hvad er forskellen mellem smeltning og størkning?
- hvad er forskellen mellem kogning og kondens?
- Beskriv de molekylære ændringer, når et fast stof bliver en væske.
- Beskriv de molekylære ændringer, når en væske bliver en gas.
- Hvad er energiændringen, når 78,0 g Hg smelter ved -38,8 liter C?
- Hvad er energiændringen, når 30,8 g al størkner ved 660 liter C?
- Hvad er energiændringen, når 111 g Br2 koger ved 59,5 liter C?
- Hvad er energiændringen, når 98,6 g H2O kondenserer ved 100 liter C?
- hver af følgende udsagn er forkert. Omskriv dem, så de er korrekte.
- temperaturændringer under en faseændring.
- processen med at en væske bliver en gas kaldes sublimering.
- hver af de følgende udsagn er forkert. Omskriv dem, så de er korrekte.
- volumenet af en gas indeholder kun omkring 10% stof, mens resten er tomt rum.
- Lyshsub er lig med Lyshvap.
- skriv den kemiske ligning til smeltning af elementært natrium.
- skriv den kemiske ligning for størkning af bensene (C6H6).
- skriv den kemiske ligning til sublimering af CO2.
- skriv den kemiske ligning til kogning af propanol (C3H7OH).
- Hvad er H2O ‘ s Lussub? (Tip: Se tabel 10.2″ entalpier af Fusion for forskellige stoffer “og tabel 10.3″entalpier af fordampning for forskellige stoffer”.)
- den I2-Lussub er 60,46 kJ/mol, mens dens Lussub er 41,71 kJ/mol. Hvad er I2 ‘ s Prishfus?
svar
- smeltning er faseændringen fra et fast stof til en væske, mens størkning er faseændringen fra en væske til et fast stof.
- molekylerne har nok energi til at bevæge sig omkring hinanden, men ikke nok til at adskille sig fuldstændigt fra hinanden.
- 890 J
- 10.7 kJ
-
- temperaturen ændres ikke under en faseændring.
- processen med, at en væske bliver en gas, kaldes kogning; processen med, at et fast stof bliver en gas, kaldes sublimering.
- Na(s))
- CO2(er) – CO2 (g))
- 46.69 kJ / mol