Luku 10. Kiinteät aineet ja nesteet
- kuvaile, mitä tapahtuu vaihemuutoksen aikana.
- lasketaan faasimuutokseen tarvittava energiamuutos.
aineet voivat vaihtaa vaihetta-usein lämpötilan muutoksen vuoksi. Alhaisissa lämpötiloissa useimmat aineet ovat kiinteitä; lämpötilan noustessa ne muuttuvat nestemäisiksi; korkeammissa lämpötiloissa niistä tulee kaasumaisia.
prosessia, jossa kiinteä aine muuttuu nesteeksi, kutsutaan sulamiseksi (vanhempi termi, jota saatetaan joskus nähdä, on fuusio). Päinvastaista prosessia, nesteen muuttumista kiinteäksi, kutsutaan jähmettymiseksi. Puhtaan aineen ominaispiirre on lämpötila, jossa sulaminen tapahtuu eli sulamispiste. Kiinteän aineen sulaminen nesteeksi vaatii energiaa. Jokaisella puhtaalla aineella on tietty määrä energiaa, jonka se tarvitsee muuttuakseen kiinteästä aineesta nesteeksi. Tätä määrää kutsutaan aineen fuusion (tai fuusiolämmön) entalpiaksi, joka esitetään ΔHfus-arvona. Taulukossa 10.2 on lueteltu eräitä ΔHfus-arvoja (”Entalpies Of Fusion for Various Substances”); näiden arvojen oletetaan olevan aineen sulamispisteen arvoja. Huomaa, että Δhfuksen yksikkö on kilojouleja moolia kohti, joten meidän on tiedettävä materiaalin määrä tietääksemme, kuinka paljon energiaa on mukana. ΔHfus taulukoidaan aina positiivisena lukuna. Sitä voidaan kuitenkin käyttää sekä sulatus-että jähmettymisprosesseissa, kunhan pidetään mielessä, että sulaminen on aina endotermistä (eli ΔH on positiivinen), kun taas jähmettyminen on aina eksotermistä (eli ΔH on negatiivinen).
| aine (sulamispiste) | ΔHfus (kJ / mol) |
|---|---|
| vesi (0°C) | 6.01 |
| Alumiini (660°C) | 10.7 |
| bentseeni (5,5°c) | 9.95 |
| etanoli (-114,3°C) | 5.02 |
| elohopea (-38,8°C) | 2.29 |
mikä on energiamuutos, kun 45,7 g H2O: ta sulaa 0°C: ssa?
liuos
H2o: n ΔHfus on 6, 01 kJ/mol. Meidän määrä on kuitenkin annettu grammayksikköinä, ei mooleina, joten ensimmäinen vaihe on muuntaa grammat mooleiksi käyttämällä H2O: n moolimassaa, joka on 18,0 g/mol. Sitten voimme käyttää ΔHfus muuntokertoimena. Koska aine sulaa, prosessi on endoterminen, joten energiamuutoksella on positiivinen merkki.
![]()
ilman merkkiä luvun oletetaan olevan positiivinen.
Testaa itse
mikä on energiamuutos, kun 108 g C6H6: ta jäätyy 5,5°c: ssa?
vastaus
-13.8 kJ
sulamisen aikana energia menee yksinomaan aineen faasin muuttamiseen; se ei mene aineen lämpötilan muuttamiseen. Sulaminen on siis isoterminen prosessi, koska aine pysyy samassa lämpötilassa. Vasta kun kaikki aine on sulanut, ylimääräinen energia menee sen lämpötilan muuttamiseen.
mitä tapahtuu, kun kiinteä aine muuttuu nesteeksi? Kiinteässä aineessa yksittäiset hiukkaset juuttuvat paikoilleen, koska hiukkasten energia ei voi voittaa molekyylien välisiä voimia. Kun energiaa saadaan enemmän (esim., nostamalla lämpötilaa), tulee piste, jossa hiukkasilla on tarpeeksi energiaa liikkua, mutta ei tarpeeksi energiaa erottuakseen. Tämä on nestefaasi: hiukkaset ovat edelleen kosketuksissa, mutta pystyvät liikkumaan toistensa ympärillä. Tämä selittää, miksi nesteet voivat omaksua astioidensa muodon: hiukkaset liikkuvat ja täyttävät painovoiman vaikutuksesta mahdollisimman pienen tilavuuden (ellei neste ole painovoimattomassa ympäristössä-KS.Kuva 10.16 ”nesteet ja painovoima”).

nesteen ja kaasun välisellä faasimuutoksella on joitakin yhtäläisyyksiä kiinteän ja nesteen väliseen faasimuutokseen. Tietyssä lämpötilassa nesteen hiukkasilla on tarpeeksi energiaa muuttuakseen kaasuksi. Prosessia, jossa neste muuttuu kaasuksi, kutsutaan kiehumiseksi (tai höyrystymiseksi), kun taas prosessia, jossa kaasu muuttuu nesteeksi, kutsutaan kondensaatioksi. Toisin kuin kiinteä / neste-muuntoprosessi, neste / kaasu-muuntoprosessiin vaikuttaa kuitenkin huomattavasti nesteen ympäröivä paine, koska paine vaikuttaa voimakkaasti kaasuihin. Tämä tarkoittaa, että lämpötila, jossa neste muuttuu kaasuksi, kiehumispiste, voi muuttua ympäröivän paineen mukana. Tämän vuoksi määrittelemme normaalin kiehumispisteen lämpötilaksi, jossa neste muuttuu kaasuksi ympäröivän paineen ollessa tasan 1 atm eli 760 torr. Ellei toisin mainita, kiehumispisteen oletetaan olevan 1 atm paineessa.
kiinteän / nestemäisen faasin muutoksen tavoin neste / kaasu-faasin muutokseen liittyy energia. Energian määrää, joka tarvitaan nesteen muuttamiseksi kaasuksi, kutsutaan höyrystymisen entalpiaksi (tai höyrystymislämmöksi), joka esitetään Δhvapina. Taulukossa 10.3 ”höyrystymisen Entalpiat eri aineille”on lueteltu eräitä ΔHvap-arvoja.; oletetaan, että nämä arvot ovat aineen normaalille kiehumispistelämpötilalle, joka on myös esitetty taulukossa. Δhvapin yksikkö on myös kilojouleja moolia kohti, joten meidän on tiedettävä materiaalin määrä tietääksemme, kuinka paljon energiaa siihen liittyy. ΔHvap on myös aina taulukoitu positiivisena lukuna. Sitä voidaan käyttää sekä kiehumiseen että tiivistymiseen, kunhan pidetään mielessä, että kiehuminen on aina endotermistä (ΔH on siis positiivinen), kun taas kondensaatio on aina eksotermistä (ΔH on negatiivinen).
| aine (normaali Kiehumispiste) | ΔHvap (kJ / mol) |
|---|---|
| vesi (100°C) | 40.68 |
| bromi (59,5°C) | 15.4 |
| bentseeni (80,1°C) | 30.8 |
| etanoli (78,3°C) | 38.6 |
| elohopea (357°C) | 59.23 |
mikä on energiamuutos, kun 66,7 g Br2: ta(g) tiivistyy nesteeksi 59,5°C: ssa?
liuos
br2: n ΔHvap on 15, 4 kJ/mol. Vaikka kyseessä on kondensaatioprosessi, voimme silti käyttää Δhvapin numeerista arvoa, kunhan tajuamme, että meidän on otettava energiaa pois, joten ΔH-arvo on negatiivinen. Energiamuutoksen suuruuden määrittämiseksi meidän on ensin muunnettava br2: n määrä mooleiksi. Sitten voimme käyttää ΔHvap muuntokertoimena.
![]()
koska prosessi on eksoterminen, todellinen arvo on negatiivinen: ΔH = -6,43 kJ.
Testaa itse
mikä on energiamuutos, kun 822 g C2H5OH: ta(ℓ) kiehuu normaalissa kiehumispisteessään 78,3°C: ssa?
vastaus
689 kJ
kuten sulamisessa, kiehumisessa energia menee yksinomaan aineen faasin muuttamiseen; se ei mene aineen lämpötilan muuttamiseen. Kiehuminen on siis myös isoterminen prosessi. Vasta kun kaikki aine on kiehunut, ylimääräinen energia menee sen lämpötilan muuttamiseen.
mitä tapahtuu, kun nesteestä tulee kaasua? Olemme jo todenneet, että neste koostuu hiukkasista, jotka ovat kosketuksissa keskenään. Kun neste muuttuu kaasuksi, hiukkaset erkanevat toisistaan, jolloin jokainen hiukkanen kulkee avaruudessa omaa tietään. Näin kaasuilla on tapana täyttää astiansa. Itse asiassa kaasufaasissa suurin osa tilavuudesta on tyhjää tilaa; vain noin tuhannesosa tilavuudesta on todellisuudessa aineen ottamaa (KS. Kuva 10.17 ”nesteet ja kaasut”). Tämä kaasujen ominaisuus selittää, miksi niitä voidaan puristaa, mitä tarkastellaan luvussa 6 ”kaasut”.
joissakin olosuhteissa kiinteä faasi voi siirtyä suoraan kaasufaasiin käymättä nestefaasin läpi,ja kaasu voi muuttua suoraan kiinteäksi. Kiinteästä kaasusta tapahtuvaa muutosta kutsutaan sublimaatioksi, kun taas käänteistä prosessia kutsutaan depositioksi. Sublimaatio on muiden faasimuutosten tavoin isotermistä. Sublimaation aikana tapahtuu mitattavissa oleva energiamuutos; tätä energiamuutosta kutsutaan sublimaation entalpiaksi, joka esitetään Δhsubina. Δhsubin ja muiden entalpian muutosten suhde on seuraava:
ΔHsub = ΔHfus + ΔHvap
sellaisenaan Δhsubia ei aina taulukoida, koska se voidaan laskea yksinkertaisesti ΔHfus-ja ΔHvap-arvoista.
sublimaatiosta on useita yleisiä esimerkkejä. Tunnettu tuote-kuivajää – on itse asiassa kiinteää hiilidioksidia. Kuivajää on kuivaa, koska se sublimoituu, jolloin kiinteä aine ohittaa nestefaasin ja menee suoraan kaasufaasiin. Sublimaatio tapahtuu -77°C: n lämpötilassa, joten sitä on käsiteltävä varoen. Jos olet joskus huomannut, että pakastimessa olevat jääpalat tuppaavat ajan myötä pienentymään, se johtuu siitä, että kiinteä vesi sublimoituu hyvin hitaasti. ”Pakastuspoltto” ei ole itse asiassa palovamma; se tapahtuu, kun tietyt elintarvikkeet, kuten lihat, menettävät hitaasti kiinteän vesipitoisuuden sublimaation vuoksi. Ruoka on edelleen hyvää, mutta ei näytä maistuvan. Pakastimen lämpötilan alentaminen hidastaa kiinteän veden sublimoitumista.
kemiallisilla yhtälöillä voidaan esittää faasimuutosta. Tällaisissa tapauksissa on erittäin tärkeää, että aineissa käytetään vaihemerkintöjä. Esimerkiksi kemiallinen yhtälö jään sulamiselle nestemäiseksi vedeksi on seuraava:
H2O(s) → H2O (ℓ)
ei tapahdu kemiallista muutosta, mutta tapahtuu fysikaalinen muutos.
Lämmityskäyrät
lämpötilan ja lisätyn lämmön määrän kuvaaja tunnetaan lämpökäyränä (KS.Kuva 10.18). Näitä käytetään yleisesti osoittamaan visuaalisesti tietyn aineen faasimuutosten ja entalpian välinen suhde.
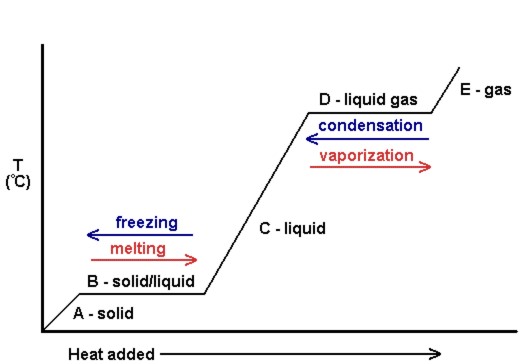
Kuvassa 10.18 kiintoaine saa liike-energiaa ja nousee näin ollen lämpötilassa, kun siihen lisätään lämpöä. Sulamispisteessä lisättyä lämpöä käytetään kiinteän aineen puoleensavetävien intermolekulaaristen voimien hajottamiseen liike-energian lisäämisen sijaan, ja siksi lämpötila pysyy vakiona. Kun kaikki kiinteä on sulanut, jälleen kerran lisätty lämpö menee lisäämään liike-energiaa (ja lämpötila) nestemolekyylien kiehumispisteeseen asti. Kiehumispisteessä jälleen kerran lisättyä lämpöä käytetään puoleensavetävien molekyylien välisten voimien hajottamiseen sen sijaan, että se toimittaisi liike-energiaa, ja lämpötila pysyy vakiona, kunnes kaikki neste on muuttunut kaasuksi.
- Faasimuutoksia voi tapahtua minkä tahansa aineen kahden faasin välillä.
- kaikki faasimuutokset tapahtuvat samanaikaisesti energian muutoksen kanssa.
- kaikki faasimuutokset ovat isotermisiä.
- Mitä eroa on sulamisella ja jähmettymisellä?
- Mitä eroa on kiehumisella ja tiivistymisellä?
- kuvaa molekyylimuutoksia, kun kiinteä aine muuttuu nesteeksi.
- kuvaa molekyylimuutoksia, kun nesteestä tulee kaasu.
- mikä on energiamuutos, kun 78,0 g Hg: tä sulaa -38,8°C: ssa?
- mikä on energiamuutos, kun 30, 8 g Al: tä jähmettyy 660°C: ssa?
- mikä on energiamuutos, kun 111 g Br2: ta kiehuu 59,5°C: ssa?
- mikä on energiamuutos, kun 98,6 g H2O: ta tiivistyy 100°C: ssa?
- jokainen seuraavista väitteistä on virheellinen. Kirjoita ne uudelleen niin, että ne ovat oikein.
- lämpötilan muutokset faasimuutoksen aikana.
- prosessia, jossa neste muuttuu kaasuksi, kutsutaan sublimaatioksi.
- jokainen seuraavista väittämistä on virheellinen. Kirjoita ne uudelleen niin, että ne ovat oikein.
- kaasun tilavuudesta on vain noin 10% ainetta, loppu on tyhjää tilaa.
- ΔHsub on yhtä suuri kuin ΔHvap.
- Kirjoita kemiallinen yhtälö alkuainenatriumin sulamiseen.
- Kirjoita kemiallinen yhtälö bentseenin jähmettymiselle (C6H6).
- Kirjoita kemiallinen yhtälö CO2: n sublimoinnille.
- Kirjoita kemiallinen yhtälö propanolin kiehumiselle (C3H7OH).
- mikä on H2o: n ΔHsub? (Vihje: Katso taulukko 10.2 ”Entalpies Of Fusion for Various Substances” ja taulukko 10.3 ”Entalpies of Vaporization for Various Substances”.)
- i2: n ΔHsub on 60, 46 kJ/mol, kun taas sen ΔHvap on 41, 71 kJ/mol. Mikä on i2: n ΔHfus?
vastaukset
- sulaminen on faasimuutosta kiinteästä nesteestä, kun taas jähmettyminen on faasimuutosta nesteestä kiinteäksi.
- molekyyleillä on tarpeeksi energiaa liikkua toistensa ympärillä, mutta ei tarpeeksi erottuakseen täysin toisistaan.
- 890 J
- 10.7 kJ
-
- lämpötila ei muutu faasimuutoksen aikana.
- prosessia, jossa neste muuttuu kaasuksi, kutsutaan kiehumiseksi; prosessia, jossa kiinteä muuttuu kaasuksi, kutsutaan sublimaatioksi.
- Na (s) → Na (ℓ)
- CO2 (s) → CO2 (g)
- 46.69 kJ / mol