PUBLICIDAD:
Este artículo arroja luz sobre los seis factores que afectan la actividad enzimática.
Los seis factores son: (1) Concentración de Enzimas (2) Concentración de Sustrato (3) Efecto de la Temperatura (4) Efecto del pH (5) Efecto de la Concentración del Producto y (6) Efecto de los Activadores.
El contacto entre la enzima y el sustrato es el requisito previo más esencial para la actividad enzimática.
ANUNCIOS:
Los factores importantes que influyen en la velocidad de la reacción enzimática se discuten a continuación:
Factor # 1. Concentración de la enzima:
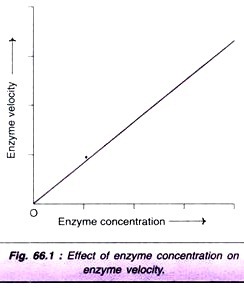
A medida que aumenta la concentración de la enzima, aumenta proporcionalmente la velocidad de la reacción (Fig. 66.1). De hecho, esta propiedad de la enzima se utiliza para determinar las actividades de las enzimas séricas para el diagnóstico de enfermedades.
Factor # 2. Concentración de Sustrato:
PUBLICIDAD:
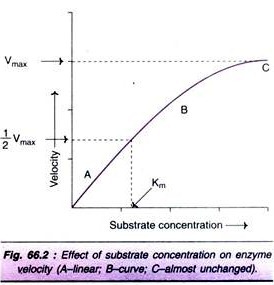
El aumento de la concentración de sustrato aumenta gradualmente la velocidad de reacción enzimática dentro del rango limitado de niveles de sustrato. Se obtiene una hipérbola rectangular cuando se traza la velocidad contra la concentración del sustrato (Fig. 66.2). En el gráfico se observan tres fases distintas de la reacción.
Cinética enzimática y valor Km:
La enzima (E) y el sustrato (S) se combinan entre sí para formar un complejo enzimático-sustrato inestable para la formación del producto (P).
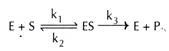
Aquí k1, k2 y k3 representan las constantes de velocidad para las reacciones respectivas, como se indica con flechas.
Km, la constante de Michaelis-Menten (o constante de Brig y Haldane), viene dada por la fórmula
![]()
La siguiente ecuación se obtiene después de una manipulación algebraica adecuada.
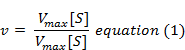
donde v = Velocidad medida,
Vmax = Velocidad máxima,
S = Concentración de sustrato,
Km = constante de Michaelis-Menten.
ANUNCIOS:
Km o la constante de Michaelis-Menten se define como la concentración de sustrato (expresada en moles / lit) para producir la velocidad media máxima en una reacción catalizada por enzimas. Indica que la mitad de las moléculas enzimáticas (es decir, el 50%) están unidas a las moléculas del sustrato cuando la concentración del sustrato es igual al valor Km.
El valor km es una constante y un rasgo característico de una enzima dada. Es un representante para medir la fuerza del complejo ES. Un valor de Km bajo indica una fuerte afinidad entre la enzima y el sustrato, mientras que un valor de Km alto refleja una afinidad débil entre ellos. Para la mayoría de las enzimas, los valores de km están en el rango de 10-5 a 10-2 moles.
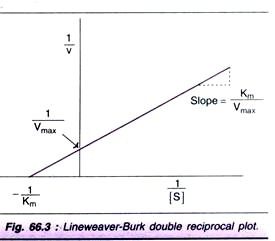
Trama doble recíproca de tejedor de líneas-Burk:
PUBLICIDAD:
Para la determinación del valor Km, la curva de saturación del sustrato (Fig. 66.2) no es muy preciso, ya que la Vmax se aborda de forma asintótica. Tomando los recíprocos de la ecuación (1), se obtiene una representación gráfica en línea recta.
La gráfica de Línea weaver-Burk se muestra en la Fig. 66.3. Es mucho más fácil calcular el Km desde la intersección en el eje x, que es- (1 / km). Además, la gráfica de doble reciprocidad es útil para comprender el efecto de varias inhibiciones.
Factor # 3. Efecto de la temperatura:
La velocidad de una reacción enzimática aumenta con el aumento de la temperatura hasta un máximo y luego disminuye. Generalmente se observa una curva en forma de campana (Fig. 66.4).
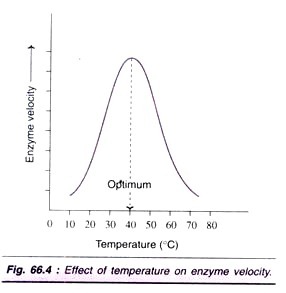
La temperatura óptima para la mayoría de las enzimas es de entre 40 ° C y 45°C. Sin embargo, algunas enzimas (por ejemplo, fosfoquinasas venenosas, adenilato quinasa muscular) están activas incluso a 100°C. En general, cuando las enzimas se exponen a una temperatura superior a 50°C, se observa una desnaturalización que conduce a un trastorno en la estructura nativa (terciaria) de la proteína y el sitio activo. La mayoría de las enzimas se vuelven inactivas a temperaturas más altas (por encima de 70°C).
Factor # 4. Efecto del pH:
El aumento de la concentración de iones de hidrógeno (pH) influye considerablemente en la actividad enzimática y normalmente se obtiene una curva en forma de campana (Fig. 66.5). Cada enzima tiene un pH óptimo a la que la velocidad es máxima.
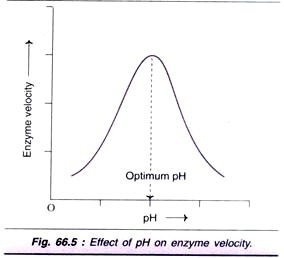
La mayoría de las enzimas de organismos superiores muestran una actividad óptima alrededor de un pH neutro (6-8). Hay, sin embargo, muchas excepciones como la pepsina (1-2), la fosfatasa ácida (4-5) y la fosfatasa alcalina (10-11) para un pH óptimo.
Factor # 5. Efecto de la concentración del producto:
La acumulación de productos de reacción generalmente disminuye la velocidad de la enzima. Para ciertas enzimas, los productos se combinan con el sitio activo de la enzima y forman un complejo suelto y, por lo tanto, inhiben la actividad enzimática. En el sistema vivo, este tipo de inhibición generalmente se evita mediante una rápida eliminación de los productos formados.
Factor # 6. Efecto de los activadores:
Algunas de las enzimas requieren ciertos cationes metálicos inorgánicos como Mg2+, Mn2+, Zn2+, Ca2+, Co2+, Cu2+, Na+, K+, etc. para su actividad óptima. En raras ocasiones, los aniones también son necesarios para la actividad enzimática, por ejemplo, el ion cloruro (CI–) para la amilasa.